Nachdem LowRoad und unser geschätzter fs auf Cabozantinib (XL 184) hingewiesen haben und Rudolf schon mit den Hufen scharrt, stelle ich eine Übersetzung der Info von Exelixis (Hersteller) ein, so dass sich auch die des Englischen nicht mächtigen (wie Hutchi es wohl formuliert hätte) über Cabozantinib informieren können.
Übersetzung aus: http://www.metinhibition.com/
Was ist die Rolle von MET bei Krebs?
MET ist in vielen Tumorarten hochreguliert
MET ist eine Rezeptor Tyrosine Kinase mit einem bekannten Liganden: hepatcyte growth factor oder HGF. In den meisten normalen Geweben findet man MET und HGF in geringen Mengen. Allerdings, in einigen Tumorarten – eingeschlossen Schilddrüse, Prostata, Eierstock und Brust – ist MET hochreguliert. Die Hochregulierung von MET kann über mehrere Mechanismen geschehen, einschließlich Gen-Mutation/ Vervielfältigung, transkriptionale Hochregulierung und Überexpression von HGF.
Ein entscheidender Auslöser der Tumorflucht und Metastasierung
Der MET Signalweg ist sehr wichtig bei Krebs, da es sich gezeigt hat , dass MET ein wesentlicher Fluchtweg für Tumorzellen ist. MET ermöglicht Tumorzellflucht durch Förderung der Bildung von aggressiveren zellulären Phänotypen. Diese Phänotypen sind gekennzeichnet durch verstärkte Aggressivität und Invasivität – Charakteristiken die Metastasierung fördern. Demzufolge, selbst wenn die Überlebensmechanismen von Tumorzellen bei einigen Krebstherapien angegriffen werden, hilft MET den Zellen durch Streuung außerhalb des lokalen Tumors zu überleben. Es hat sich gezeigt, dass Hochregulierung der MET Signalwege eine Reaktion auf einige zielgerichtete Therapien ist und den Krebszellen erlaubt dem Tod zu entgehen und den Progress fortzusetzen.
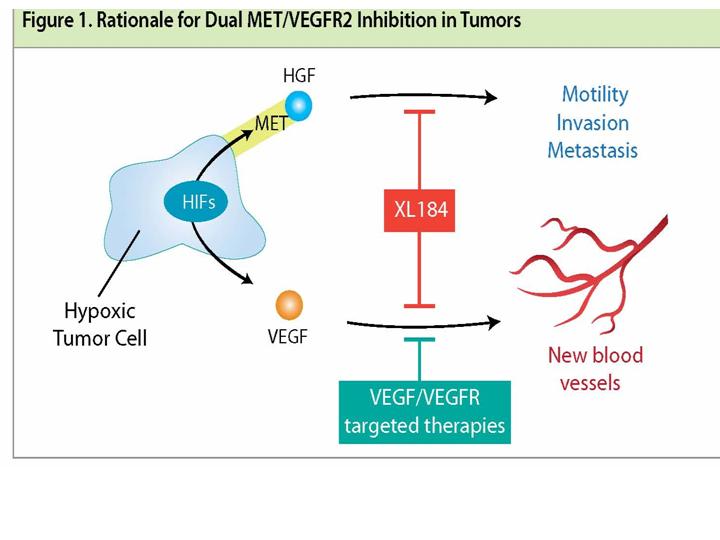
Was ist die Verbindung zwischen den MET- und VEGF – Signalwegen?
Hypoxie verursacht durch Hemmung der Angiogenese kann die Hochregulierung von MET vorantreiben.Einige derzeitige Krebstherapien, einschließlich Angiogenesehemmer, lassen MET nicht nur unberücksichtigt, sondern können sogar die Stimulation seiner Aktivität fördern. Es hat sich gezeigt, dass VEGF, ein häufiges Ziel der Angiogensehemmer, hilft, die MET - abhängige Tumorinvasion einzudämmen. Wenn VEGF blockiert wird, geschehen folgende Abläufe:
1. Hypoxie im Tumorumfeld, eine typische Charakteristik solider Tumoren, verschlimmert sich
2. Die Sauerstoff – entzogenen Tumorzellen hochregulieren MET noch mehr
3. Die Zellen transformieren sich in aggressivere Phänotypen
4. Die Zellen entgehen dem Tod
Diese Geschehnisse machen den MET Fluchtweg besonders relevant während einer Therapie mit Angiogenesehemmern.
Zusätzlich exprimiert MET Endothelzellen, und der MET Ligand HGR ist ein sehr starker angiogenesischer Faktor, der mit VEGF kooperiert um die Tumor – Gefäßneubildung voranzutreiben. Folglich ermöglicht der MET Pathway das Tumorüberleben und Flucht durch eine Intensivierung der Angiogenese.
Ausweichwiderstand beobachtet bei VEGF Pathway Inhibitoren
In präklinischen Studien wurden hochvaskularisierte Bauchspeichel – Brust – und Glioblasom – Tumore mit VEGF Pathway Hemmern behandelt. Das anfängliche Ansprechen war ein Rückgang der Vaskularisierung, begleitet mit Tumorstillstand. Allerdings wurden die Tumoren anschließend revaskularisiert und zeigten eine gesteigerte Invasivität. Diese Adaption eines Tumors ist bekannt als Ausweichwiderstand und könnte bei einer zielgerichteten Therapie, die allein auf den VEGF Pathway ausgerichtet ist, Anlass zu Bedenken geben. Während die alleinige Blockade des VEGF Pathways eine unmittelbare Antitumor Wirkung haben kann, so kann der Ausweichwiderstand über den MET Flucht- weg längerfristig das Krebswachstum begünstigen.
In wieweit ist MET beteiligt an Knochenmetastasen?
In vielen Tumorarten wie kastrations-resistentem Prostatakrebs (CRCP) sind Knochenmetastasen verantwortlich für die Mehrheit der Komorbidität und letztendlich Mortalität. Chemotherapie verbessert Überleben, hat aber einen begrenzten Einfluss auf Knochenmetastasen. Auf Knochen gezielte Therapien verringern knochenbezogene Geschehnisse, haben aber keinen Einfluss auf Überleben bei den meisten soliden Tumoren. Daher bedeuten Knochenmetastasen eine klinische Herausforderung mit begrenzt verfügbaren Lösungen.
Aktivität von MET in den Knochen
Obwohl Knochenmetastasen oft nicht auf Behandlung ansprechen, ist das neu entstehende Verständnis von MET hilfreich, Einblicke in die Mechanismen von Knochenläsion-Entwicklung zu geben. MET ist nicht nur in Tumorzellen und Endothalzellen exprimiert, sondern auch in Osteoblasten (Knochen bildende Zellen) und Osteoklasten (Knochen abbauende Zellen). HGF bindet an MET bei all diesen Zelltypen, und geben MET eine wichtige Rolle in multiplen Autocrinen und Paracrinen Schleifen.
Aktivierung von MET in Tumorzellen können wichtig für die Bildung von Knochenläsionen sein. Gleichzeitig kann die Aktivierung der MET Pathways in Osteoblasten und Osteoklasten zu pathologischen Besonderheiten bei Knochenmetastasen, eingeschlossen abnormales Knochenwachstum (z.B. blastische Läsionen) oder Zerstörung ( z.B.lytische Läsionen ) führen. Demzufolge könnte direktes Targeting des MET Pathways eine praktikable Strategie sein, die Bildung und Progression metastati- scher Knochenläsionen zu verhindern.
Knochenmetastasen bei kastrations-resistentem Prostatakrebs
Hohe Spiegel von MET Expression sind in Proatatkrebs Knochenmetastasen bei human Patienten beobachtet worden. In präklinischen Studien hat Androgen Deprivation eine erhöhte MET Expression gezeigt, was auf einen potentiellen Mechanismus für die Prävalenz von Knochenmetastasen bei dieser Krebsart hinweist.
Wie wirkt die duale Hemmung von MET und VEGF2
Angesichts der koordinierten Aktivität der MET und VEGF Pathways in Weichteil- und Knochen-Tumoren, könnte es eine wichtige klinische Rolle für Therapien geben, welche die beiden Pathways gleichzeitig hemmen. Solche Therapien können die Angiogenese blockieren während sie die Tumoren daran hindern invasiver zu werden, Tumorzellen zu töten und gleichzeitig die Fluchtwege blockieren.
Ein dualer Inhibitor der MET und VEGF Pathways könnte so MET induzierte Flucht, beobachtet bei Therapien welche den VEGF Pathway alleine hemmen, vermeiden und eine starke Blockade gegen Krebsprogression und Metastasen bieten.
Über Cabozantinib: Ein potenter, dualer Inhibitor von MET und VEGF2
Cabozantinib ein potenter, dualer Inhibitor von MET und VEGF2 wurde entwickelt um die MET angetriebene Tumorflucht zu blockieren. Dieser Wirkstoff wurde bereits in multiplen präklinischen Studien untersucht und hat Tumor abtötende, antimetastatische und antiangiogenesisiche Wirkungen gezeigt, einschließlich:
• Extensive Apoptose maligner Zellen
• Reduzierte Tumor- und Endothal- Zellproliferation
• Reduzierte Tumor - Invasivität und Metastasierung
• Blockade metastatischer Knochenläsion - Progression
• Unterbrechung von Tumor - Gefäßneubildung
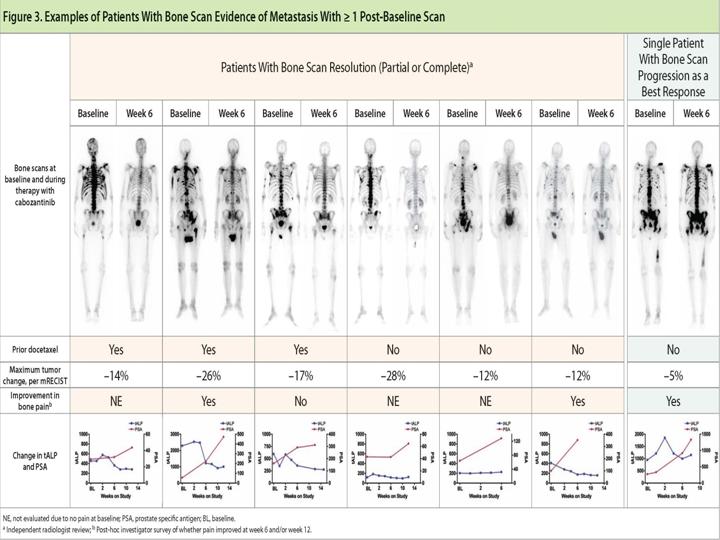
Hier noch ein Link, leider nur englisch. mit einem interessanten Poster, den man vergrößern kann, das vergleichende Szinti-Aufnahmen zeigt.
Bleibt nur zu hoffen, dass Cabozantinib nicht zu lange in der Studien/Zulassungsschleife hängen bleibt.
Gruß
JürgenS
Übersetzung aus: http://www.metinhibition.com/
Was ist die Rolle von MET bei Krebs?
MET ist in vielen Tumorarten hochreguliert
MET ist eine Rezeptor Tyrosine Kinase mit einem bekannten Liganden: hepatcyte growth factor oder HGF. In den meisten normalen Geweben findet man MET und HGF in geringen Mengen. Allerdings, in einigen Tumorarten – eingeschlossen Schilddrüse, Prostata, Eierstock und Brust – ist MET hochreguliert. Die Hochregulierung von MET kann über mehrere Mechanismen geschehen, einschließlich Gen-Mutation/ Vervielfältigung, transkriptionale Hochregulierung und Überexpression von HGF.
Ein entscheidender Auslöser der Tumorflucht und Metastasierung
Der MET Signalweg ist sehr wichtig bei Krebs, da es sich gezeigt hat , dass MET ein wesentlicher Fluchtweg für Tumorzellen ist. MET ermöglicht Tumorzellflucht durch Förderung der Bildung von aggressiveren zellulären Phänotypen. Diese Phänotypen sind gekennzeichnet durch verstärkte Aggressivität und Invasivität – Charakteristiken die Metastasierung fördern. Demzufolge, selbst wenn die Überlebensmechanismen von Tumorzellen bei einigen Krebstherapien angegriffen werden, hilft MET den Zellen durch Streuung außerhalb des lokalen Tumors zu überleben. Es hat sich gezeigt, dass Hochregulierung der MET Signalwege eine Reaktion auf einige zielgerichtete Therapien ist und den Krebszellen erlaubt dem Tod zu entgehen und den Progress fortzusetzen.
Was ist die Verbindung zwischen den MET- und VEGF – Signalwegen?
Hypoxie verursacht durch Hemmung der Angiogenese kann die Hochregulierung von MET vorantreiben.Einige derzeitige Krebstherapien, einschließlich Angiogenesehemmer, lassen MET nicht nur unberücksichtigt, sondern können sogar die Stimulation seiner Aktivität fördern. Es hat sich gezeigt, dass VEGF, ein häufiges Ziel der Angiogensehemmer, hilft, die MET - abhängige Tumorinvasion einzudämmen. Wenn VEGF blockiert wird, geschehen folgende Abläufe:
1. Hypoxie im Tumorumfeld, eine typische Charakteristik solider Tumoren, verschlimmert sich
2. Die Sauerstoff – entzogenen Tumorzellen hochregulieren MET noch mehr
3. Die Zellen transformieren sich in aggressivere Phänotypen
4. Die Zellen entgehen dem Tod
Diese Geschehnisse machen den MET Fluchtweg besonders relevant während einer Therapie mit Angiogenesehemmern.
Zusätzlich exprimiert MET Endothelzellen, und der MET Ligand HGR ist ein sehr starker angiogenesischer Faktor, der mit VEGF kooperiert um die Tumor – Gefäßneubildung voranzutreiben. Folglich ermöglicht der MET Pathway das Tumorüberleben und Flucht durch eine Intensivierung der Angiogenese.
Ausweichwiderstand beobachtet bei VEGF Pathway Inhibitoren
In präklinischen Studien wurden hochvaskularisierte Bauchspeichel – Brust – und Glioblasom – Tumore mit VEGF Pathway Hemmern behandelt. Das anfängliche Ansprechen war ein Rückgang der Vaskularisierung, begleitet mit Tumorstillstand. Allerdings wurden die Tumoren anschließend revaskularisiert und zeigten eine gesteigerte Invasivität. Diese Adaption eines Tumors ist bekannt als Ausweichwiderstand und könnte bei einer zielgerichteten Therapie, die allein auf den VEGF Pathway ausgerichtet ist, Anlass zu Bedenken geben. Während die alleinige Blockade des VEGF Pathways eine unmittelbare Antitumor Wirkung haben kann, so kann der Ausweichwiderstand über den MET Flucht- weg längerfristig das Krebswachstum begünstigen.
In wieweit ist MET beteiligt an Knochenmetastasen?
In vielen Tumorarten wie kastrations-resistentem Prostatakrebs (CRCP) sind Knochenmetastasen verantwortlich für die Mehrheit der Komorbidität und letztendlich Mortalität. Chemotherapie verbessert Überleben, hat aber einen begrenzten Einfluss auf Knochenmetastasen. Auf Knochen gezielte Therapien verringern knochenbezogene Geschehnisse, haben aber keinen Einfluss auf Überleben bei den meisten soliden Tumoren. Daher bedeuten Knochenmetastasen eine klinische Herausforderung mit begrenzt verfügbaren Lösungen.
Aktivität von MET in den Knochen
Obwohl Knochenmetastasen oft nicht auf Behandlung ansprechen, ist das neu entstehende Verständnis von MET hilfreich, Einblicke in die Mechanismen von Knochenläsion-Entwicklung zu geben. MET ist nicht nur in Tumorzellen und Endothalzellen exprimiert, sondern auch in Osteoblasten (Knochen bildende Zellen) und Osteoklasten (Knochen abbauende Zellen). HGF bindet an MET bei all diesen Zelltypen, und geben MET eine wichtige Rolle in multiplen Autocrinen und Paracrinen Schleifen.
Aktivierung von MET in Tumorzellen können wichtig für die Bildung von Knochenläsionen sein. Gleichzeitig kann die Aktivierung der MET Pathways in Osteoblasten und Osteoklasten zu pathologischen Besonderheiten bei Knochenmetastasen, eingeschlossen abnormales Knochenwachstum (z.B. blastische Läsionen) oder Zerstörung ( z.B.lytische Läsionen ) führen. Demzufolge könnte direktes Targeting des MET Pathways eine praktikable Strategie sein, die Bildung und Progression metastati- scher Knochenläsionen zu verhindern.
Knochenmetastasen bei kastrations-resistentem Prostatakrebs
Hohe Spiegel von MET Expression sind in Proatatkrebs Knochenmetastasen bei human Patienten beobachtet worden. In präklinischen Studien hat Androgen Deprivation eine erhöhte MET Expression gezeigt, was auf einen potentiellen Mechanismus für die Prävalenz von Knochenmetastasen bei dieser Krebsart hinweist.
Wie wirkt die duale Hemmung von MET und VEGF2
Angesichts der koordinierten Aktivität der MET und VEGF Pathways in Weichteil- und Knochen-Tumoren, könnte es eine wichtige klinische Rolle für Therapien geben, welche die beiden Pathways gleichzeitig hemmen. Solche Therapien können die Angiogenese blockieren während sie die Tumoren daran hindern invasiver zu werden, Tumorzellen zu töten und gleichzeitig die Fluchtwege blockieren.
Ein dualer Inhibitor der MET und VEGF Pathways könnte so MET induzierte Flucht, beobachtet bei Therapien welche den VEGF Pathway alleine hemmen, vermeiden und eine starke Blockade gegen Krebsprogression und Metastasen bieten.
Über Cabozantinib: Ein potenter, dualer Inhibitor von MET und VEGF2
Cabozantinib ein potenter, dualer Inhibitor von MET und VEGF2 wurde entwickelt um die MET angetriebene Tumorflucht zu blockieren. Dieser Wirkstoff wurde bereits in multiplen präklinischen Studien untersucht und hat Tumor abtötende, antimetastatische und antiangiogenesisiche Wirkungen gezeigt, einschließlich:
• Extensive Apoptose maligner Zellen
• Reduzierte Tumor- und Endothal- Zellproliferation
• Reduzierte Tumor - Invasivität und Metastasierung
• Blockade metastatischer Knochenläsion - Progression
• Unterbrechung von Tumor - Gefäßneubildung
Hier noch ein Link, leider nur englisch. mit einem interessanten Poster, den man vergrößern kann, das vergleichende Szinti-Aufnahmen zeigt.
Bleibt nur zu hoffen, dass Cabozantinib nicht zu lange in der Studien/Zulassungsschleife hängen bleibt.
Gruß
JürgenS

Kommentar